Аккумулятор – это химический источник тока многократного действия. Он способен накапливать, длительно сохранять и отдавать по мере надобности электрическую энергию, полученную от внешнего источника постоянного тока.
Во время заряда, когда внешний источник постоянного тока подключен к аккумулятору, электрическая энергия этого источника превращается в химическую энергию активных веществ, входящих в состав аккумулятора. При разряде, когда внешний источник отключен, а аккумулятор замкнут на сопротивление нагрузки, химическая энергия, накопленная в аккумуляторе, вновь преобразуется в электрическую энергию, которая расходуется нагрузкой. Аккумулятор состоит из положительной и отрицательной пластин, активная часть которых погружена в раствор электролита (водного растовора серной кислоты). Первоначальным материалом положительных и отрицательных электродов аккумулятора является свинец. После заряда аккумулятора на положительном электроде образуется активная масса – двуокись свинца (PbO2), а на отрицательном – губчатый свинец (Pb). Когда аккумулятор заряжен, концентрация серной кислоты в растворе высокая, т.е. электролит имеет повышенную плотность. Разряд аккумулятора представляет собой электрохимический процесс, при котором двуокись свинца и губчатый свинец превращаются в сульфат свинца (PbSO4).
Химическая реакция, происходящая в акумуляторе, описывается уравнением:
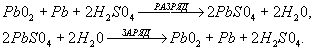
В процессе заряда сульфат свинца на отрицательных пластинах восстанавливается до губчатого свинца, а на положительных пластинах превращается в двуоксиь свинца. При этом образуется серная кислота и расходуется вода. Концентрация кислоты, т.е. плотность электролита, повышается. Если заряд продолжать дальше, то весь зарядный ток будет расходоваться на разложение воды с бурным выделением образующихся газов - водорода и кислорода.
Электрические харктеристики аккумуляторов
1. Емкость аккумулятора – это количество электричества, которое можно получить от аккумулятора в определенных условиях разряда.
Номинальная емкость аккумуляторов приведенная к условному 10-часовому режиму разряда и температуре среды 20оС зависит от ряда факторов: тока разряда Iр, времени разряда tр и соответствующего ему коэффициента отдачи по емкости hQ, температуры окружающей среды tср:
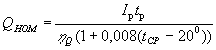
Значения коэффициента отдачи по емкости h Q приведены в таблице. В таблице указаны также коэффициенты кратности тока hi, определяющие превышение разрядного тока приведенной величины в 10-часовом режиме разряда (hi=Iр/ Iр10).
|
tр , ч |
10 |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
|
hQ |
1 |
0,97 |
0,94 |
0,91 |
0,89 |
0,83 |
0,8 |
0,75 |
0,61 |
0,51 |
|
hi |
1 |
1,1 |
1,15 |
1,3 |
1,48 |
1,66 |
2,0 |
2,5 |
3,05 |
5,1 |
2. Номинальное напряжение аккумулятора – это напряжения на выводах полность заряженнного исправного аккумулятора в течение первого часа разряда током 10 – часового режима разряда при температуре электролита 20°С (UЭЛ.НОМ =2 В).
Количество элементов в батарее определяется отношением:
![]()
В процессе заряда и разряда аккумуляторов напряжение элемента изменяется на ±0,2…0,22 В.
3. Напряжение в конце разряда равно UЭЛ.КЗ=(1,75…1,8)В. При разряде аккумулятора токами, превышающими ток 10 – часового режима разряда, напряжение в процессе разряда будет понижаться быстрее, чем в 10 - часовом режиме и дойдет до уровня 1,8В, когда с аккумулятора еще не снята номинальная емкость. В таких случаях показателем окончания разряда является величина напряжения элемента.
4. Величина напряжения при заряде должна быть больше ЭДС, так как зарядному току приходится преодолевать внутреннее сопротивление аккумулятора: UЗАР=E+IЗ×RВН =(2,3…2,35)В.
5. Внутреннее сопротивление аккумулятора RВН складывается из сопротивления аккмуляторных пластин, сепараторов и электролита. Внутреннее сопротивление увеличивается по мере разряда в силу уменьшения плотности элетролита, а также в связи с образованием сульфата свинца. Омическое сопротивление полностью заряженного аккумулятора составляет примерно 0,0036 Ом, а в состоянии полного разряда – 0,007 Ом.
6. Плотность электролита заряженного аккумулятора составляет (1,25…1,3) г/ см3 , в состоянии разряда – 1,05 г/ см3.
Современные типы аккумуляторов
Закрытые негерметичные аккумуляторы (ЗНА) выпускают в настоящее время ряд зарубежных фирм. Основными представителями рынка негерметичных аккумуляторов для электросвязи являются CHLORIDE inc., VARTA GmbH, HAGEN GmbH, YUASA Corp., OLDHAM France.
Конструкция (ЗНА) предполагает технологию изготовления, сходную с открытыми аккумуляторами, но обеспечивающую пониженное испарение воды. Газы, выделяющиеся при заряде-разряде собираются в резервуаре над слоем электролита.
Широкое распространение на практике получила “прозрачная” конструкция кислотных аккумуляторов. Она практически едина для разных фирм-изготовителей. Корпус аккумулятора изготавливается из прозрачного ударопрочного материала, в верхней части корпуса имеется транспортная (заливная) пробка. В закрытом состоянии эта пробка обеспечивает газообмен внутренней полости аккумуляторного элемента с окружающей средой. После извлечения пробки обеспечивается доступ к поверхностному слою электролита и к верхним частям пластин.
Благодаря описанной конструкции возможно:
- визуально контролировать уровень электролита в каждом элементе батареи и его чистоту;
- определять сульфатацию торцов пластин;
- наблюдать “кипение” электролита при заряде;
- ареометром проверять плотность электролита;
- делать отбор электролита на лабораторный анализ
Тем не менее не представляется возможным наблюдать сульфатацию и коробление внутренних пластин, сравнивать и измерять, делать анализ глубинных слоёв электролита, хотя в технических описаниях указывается, что состав электролита, сульфатация и деформация пластин внутри объёма аккумуляторного элемента различны.
Все ЗНА можно условно разделить на два типа:
А) Конструкция с избыточным объёмом электролита –обеспечивает запас на “выкипание”, так что долив электролита необходим примерно 1 раз в год.
Б) Конструкция с доливом воды –аналогична закрытой конструкции, но предполагает в дополнение наличие резервуара с дистиллированной водой, снабжённого мерным клапаном. При понижении уровня электролита клапан открывается и происходит пополнение аккумуляторного бака. Плотность электролита при этом не регулируется, и, вследствие частичной летучести серной кислоты, происходит разбавление электролита.
Все современные негерметичные конструкции не рассчитаны на разборку и ремонт. Вскрытие возможно лишь путём нарушения целостности корпуса с опасностью последующего протекания электролита.
Герметичные аккумуляторы с рекомбинацией газа
Наличие отмеченных выше недостатков “классических” аккумуляторов привело к созданию герметичных аккумуляторов (ГА) с рекомбинацией газа и регулированием газовыделения. В зарубежной литературе они получили название VRLA (Valve Regulated Lead Acid). В настоящее время, благодаря новым техническим решениям, ГА обладают в 8…9 раз большей энергией на единицу массы по сравнению с открытыми.
Конструкция герметичных аккумуляторов
В отличие от негерметичных ГА изготавливаются из непрозрачной пластмассы. На верхней крышке расположены выходные клеммы и регулирующий клапан (Valve). Часто регулирующий клапан скрыт декоративно-защитной панелью и обнаружить его трудно. Регулирующий клапан имеет принципиальное отличие от пробки негерметичного аккумулятора, хотя в некоторых моделях выглядит как заливная пробка.
Следует отметить, что замена и пополнение электролита в ГА невозможны, равно как и контроль плотности электролита и сульфатации пластин. В этом смысле герметичные аккумуляторы относятся к “безуходным”, неремонтопригодным элементам.
Регулирующий клапан осуществляет одностороннее пропускание газов из бака аккумулятора наружу, но препятствует проникновению газообразных и иных примесей внутрь бака. Избыточное давление, создаваемое внутри бака регулируется клапаном и способствует протеканию процессов рекомбинации газа. Кроме того, клапан выполняет защитную функцию – предохраняет бак от разрушения повышенным внутренним давлением при кипении электролита.
ГА различаются способом абсорбции (связывания) электролита и газов. Из анализа технических описаний герметичных аккумуляторов таких фирм как YUASA, CHLORIDE, VARTA, HAGEN, OLDHAM France, выделено два типа связывания электролита:
А) Пропитка микропористого (стекловолоконного) сепаратора (МС) сернокислотным электролитом. Капиллярная структура сепаратора предотвращает вытекание электролита. По такому принципу строятся аккумуляторы фирм OLDHAM France, YUASA и CHLORIDE.
Б) Электролит с желеобразным силиконом, нетекучей, вязкой консистенции. Сепаратор в этом случае изготавливается аналогично “классическим” аккумуляторам. По такому принципу строятся аккумуляторы VARTA и HAGEN.
Стекловолоконный МС плотно прилегает к пластинам и препятствует их осыпанию, выполняя роль “опалубки” для активной массы.
Желеобразный электролит используется совместно с сепараторами сетчатой или гофрированной конструкции, поэтому процессы осыпания пластин в желейных (гельных) аккумуляторах более интенсивны. Технологически желе-технология более дешева, однако, технические характеристики аккумуляторов уступают элементам с микропористым сепаратором.

